TOPキーワード
プレスリリース
病原性真菌の細胞壁形成に重要なガラクトフラノース鎖を合成する酵素GfsAの立体構造を世界で初めて解明
2024年11月06日


病原性真菌の細胞壁形成に重要な
ガラクトフラノース鎖を合成する酵素GfsAの立体構造を
世界で初めて解明
崇城大学生物生命学部生物生命学科 岡拓二 教授、平大輔 教授、門岡千尋 助教、九州大学大学院農学研究院 角田佳充 教授、寺本岳大 助教らは、真菌の細胞壁に含まれる珍しい糖鎖であるガラクトフラノース鎖の合成酵素であるGfsAの立体構造を明らかにし、5位水酸基への特異的な糖転移反応メカニズムを解明しました。本研究結果は 2024 年 10月 25 日に「PNAS Nexus」に掲載されました。
【発表のポイント】
・ガラクトフラノース転移酵素GfsAの結晶構造を世界で初めて解明
・GfsAのもつ5位水酸基への特異的ガラクトフラノース転移メカニズムを解明
・新規の抗真菌薬・農薬の開発に向けた重要な基礎的知見を提供
【研究の背景と意義】
アスペルギルス・フミガーツスは肺アスペルギルス症の主要な原因菌であり、特に免疫力が低下した方に致命的な感染症を引き起こす場合があります。しかし、肺アスペルギルス症に対する効果的な治療薬は限られており、既存の抗真菌薬に対する耐性菌の出現が世界的な問題となっています。真菌の細胞壁は細胞を保護するために必要不可欠な構造体で、主に5種類の糖鎖が三次元的に複雑に絡み合って形成されています。GfsAは細胞壁を構成する糖鎖の1つであるガラクトフラノース鎖の合成を担う中心的な酵素です。GfsAは2013年に岡教授らによって発見された糖転移酵素であり、UDP-α-ガラクトフラノースを糖供与体として、β-ガラクトフラノースの5位水酸基にβ-ガラクトフラノースを連続的に転移し、最大で鎖長7のβ-(1→5)-結合ガラクトフラノース鎖を合成します(図1)。GfsAは、この反応を担う酵素であり、国際生化学・分子生物学連合によってECナンバー 2.4.1.398が付与されています。gfsA遺伝子を破壊した菌株では、正常な細胞壁を作ることができず、菌糸の伸長が抑制されることが確認されています。しかし、GfsAの結晶構造やガラクトフラノース転移反応メカニズムはこれまで不明であり、抗真菌薬開発の障害となっていました。
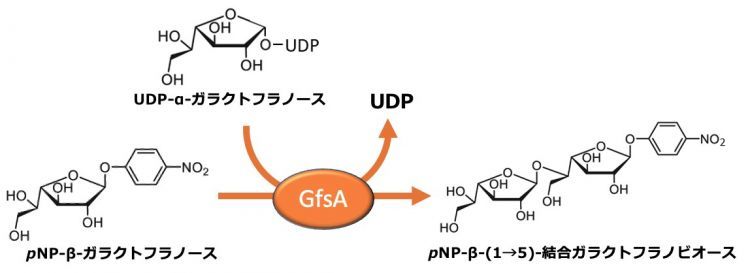
図1 GfsAの酵素反応の概略図
【研究の内容と成果】
崇城大学および九州大学の共同研究チームは、GfsAの結晶構造を明らかにしました。GfsAは二量体を形成しており、糖転移酵素によく見られるGT-A フォールドドメインに加えて、N-末端領域とC末端領域で形成される独自のドメインを有していることがわかりました(図2)。さらに、GfsAはマンガンイオン(Mn2+)、UDP、β-ガラクトフラノース残基と酵素-基質複合体を形成しました(図2)。本来の糖供与基質であるUDP-α-ガラクトフラノースを含む酵素-基質複合体予測モデルを構築することで、β-ガラクトフラノースの5位水酸基への特異的な転移メカニズムを明らかにしました(図3)。
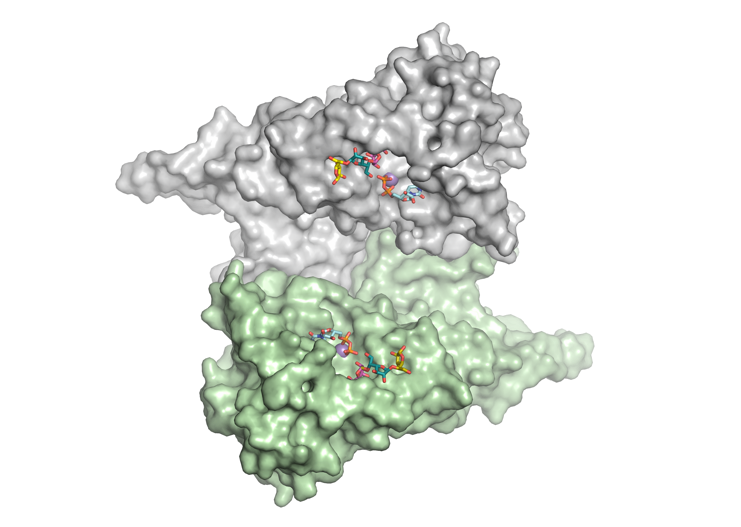
図2 GfsAの酵素-基質複合体の立体構造(二量体)
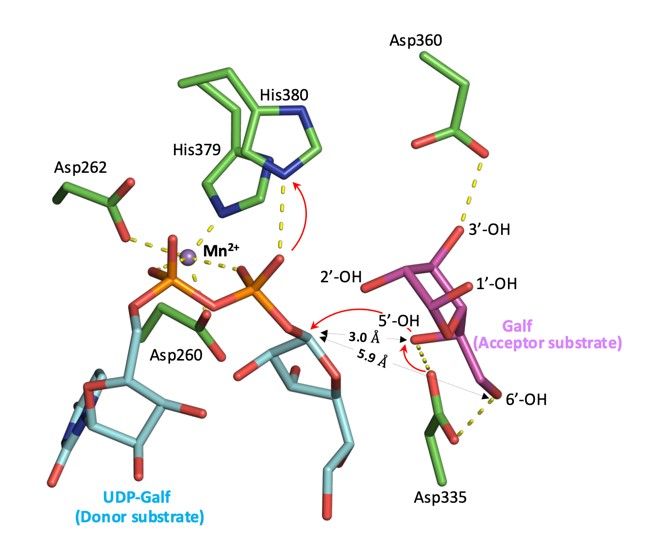
図3 GfsAの5位水酸基への特異的糖転移反応メカニズム
【研究成果の社会的意義】
GfsAの立体構造は、真核生物由来のガラクトフラノース転移酵素として世界で初めて明らかにされました。また、本研究の成果は、GfsAを標的とする新しい抗真菌薬の開発に向けた重要な知見を提供します。ガラクトフラノース鎖の合成を阻害することで、病原性真菌の細胞壁を弱体化させ感染力を低下させることができます。よって、GfsAの触媒部位を選択的に阻害する化合物は、新規の作用機序を有する抗真菌薬として使うことができる可能性があります。さらに、GfsAはアスペルギルス・フミガーツスだけでなく、多くの動物病原菌・植物病原菌に保存された酵素です。肺アスペルギルス症だけでなく、その他の真菌感染症に対する治療薬や植物病に対する農薬の開発に繋がることも期待できます。
【今後の展望と応用】
GfsAの結晶構造が明らかになったことにより、コンピューター・シミュレーションによる予測結果に基づいた阻害剤のスクリーニングが可能となります。これにより、数年以内にGfsAを標的とする新たな抗真菌薬の開発が期待できます。
【本研究成果の発表】
本研究成果は、国際科学誌『PNAS Nexus』に2024年10月25日付で掲載されました。
【研究者からのコメント】
「GfsAの結晶構造を解明できたことは、新たな抗真菌薬・農薬の開発に向けた大きな一歩です。これまで不明であったGfsAの糖転移メカニズムを詳細に理解することができ、今後は阻害剤となる化合物のスクリーニングに向けてさらなる研究を進めていきたいと考えています。」(崇城大学 生命科学部 岡 拓二)
【発表者】
崇城大学 生物生命学部:
• 岡 拓二 教授
• 平 大輔 教授
• 門岡 千尋 助教
• 千原 由莉亜 氏(研究当時:学生)
九州大学 大学院農学研究院:
• 角田 佳充 教授
• 寺本 岳大 助教
• 奥野 綾菜 氏(研究当時:学生)
• 平田 理桜 氏(学生)
【論文情報】
論文タイトル:Substrate binding and catalytic mechanism of UDP-α-D-galactofuranose: β-galactofuranoside β-(1→5)-galactofuranosyltransferase GfsA
著者名:Takuji Oka*, Ayana Okuno, Daisuke Hira, Takamasa Teramoto, Yuria Chihara, Rio Hirata, Chihiro Kadooka, Yoshimitsu Kakuta*
雑誌名:PNAS Nexus
DOI: 10.1093/pnasnexus/pgae482 公開日:2024 年10 月 25 日
【研究資金】
本研究は、岡拓二 教授、平大輔 教授、門岡千尋 助教、寺本岳大 助教、角田佳充 教授らに対する科学研究費助成事業(21K05373 (T.O.), 24K08694 (T.O.), 23K05032 (D.H.), 22K14817 (C.K.), 21K05384 (Y.K.), 24K09353 (Y.K.), 21K06032 (T.T.))と寺本岳大 助教、角田佳充 教授に対する九州大学 大学改革活性化制度の支援、および岡拓二 教授に対する公益財団法人発酵研究所一般研究助成(G-2023-2-068 (T.O.))の一環として実施されました。
取材に関する問合せ先
崇城大学 広報課
• TEL:096-326-3417
• E-mail:koho@ofc.sojo-u.ac.jp
九州大学 広報課
• TEL:092-802-2130
• E-mail:koho@jimu.kyushu-u.ac.jp
研究に関する問合せ先
崇城大学 生物生命学部生物生命学科
教授 岡 拓二
• TEL:096-326-3986
• E-mail:oka@bio.sojo-u.ac.jp
九州大学 大学院農学研究院
教授 角田 佳充
• TEL:092-642-2854
• E-mail:kakuta@agr.kyushu-u.ac.jp
